#트라젠타정 #트라젠타정복용 #트라젠타정부작용 #트라젠타정이상반응 #트라젠타정성분

아프면 병원에 가고, 병원에 가서 검사를 받고, 의사가 처방한 약을 먹잖아요?
그러다보면 문득 이 약이 뭘까? 하는 생각이 들 때가 있더라고요.
내 몸에 맞는 약인지, 부작용은 없는지, 어디에 작용하는 약인지 등..
궁금한 데 어디가서 물어볼 수도 없고, 그렇다고 안 먹을 수도 없고.
그래서 인터넷상에 올라온 약 종류에 대한 글을 적으려고 해요.
의사나 약사가 아니라서 글이 정확하지 않다는 점 유의하시고 읽어주세요.
(가장 정확한 방법은 의사나 약사와 얘기하는 거예요~)
조금이나마 포스팅을 읽는 분들께 도움이 됐으면 좋겠네요 :)
출처는 https://terms.naver.com/medicineSearch.nhn

https://terms.naver.com/entry.nhn?docId=2127247&cid=51000&categoryId=51000
트라젠타정
[외형정보] · 성상 : 양쪽이 볼록하고 사각면이 날이 선 밝은 빨강색의 원형 필름코팅정. 한쪽 면에는 베링거인겔하임 표식, 다른 한쪽 면에는 ‘D5’가 새겨져 있다. · 제형 : 필름코팅정 · 모양 : 원형 · 색상 : 분홍 · 식별표기 : (앞)마크, (뒤)D5 [성분정보] 리나글립틴 5mg [저장방법] 기밀용기, 실온보관(1~30℃) [효능효과] 이 약은 제2형 당뇨병 환자의 혈당조절을 향상시키기 위해 식사요법 및 운동요법의 보조제로 투여한다. 1.
terms.naver.com
트라젠타정
[ Trajenta Tab. ]
식약처 분류 : 대사성 의약품 > 기타의 대사성 의약품 > 당뇨병용제
구분 : 전문 의약품
제조(수입) 업체명 : 한국베링거인겔하임
제조·수입 구분 : 수입
보험코드 : 653501380
임산부 금기 등급 : 2등급 : 명확한 임상적 근거 또는 사유가 있는 경우 부득이하게 사용
외형정보
· 성상 : 양쪽이 볼록하고 사각면이 날이 선 밝은 빨강색의 원형 필름코팅정. 한쪽 면에는 베링거인겔하임 표식, 다른 한쪽 면에는 ‘D5’가 새겨져 있다.
· 제형 : 필름코팅정
· 모양 : 원형
· 색상 : 분홍
· 식별표기 : (앞)마크, (뒤)D5
성분정보
리나글립틴 5mg
저장방법
기밀용기, 실온보관(1~30℃)
이상반응
1) 단독 요법 및 병용요법
이 약의 안전성은 제2형 당뇨병 환자 중 이 약 5 mg이 투여된 환자를 통해 평가되었다. 위약-대조군 시험에서 10,963명의 피험자 중 6,580명의 피험자에 대하여 치료용량인 리나글립틴 5mg이 투여되었다. 위약-대조군 시험에서 발췌 분석한 결과, 위약 투여군과 리나글립틴 5 mg 투여군의 전체적인 이상반응 발현률이 유사하였다 (63.4% 대 59.1%). 이상반응에 의해 치료를 중단한 피험자는 리나글립틴 5 mg투여군(3.4%)에 비해 위약 투여군(4.3%)이 높았다. 단독요법, 초기 병용 용법 또는 추가 병용요법으로 리나글립틴 5 mg이 투여된 이중눈가림시험에서 보고된 이상반응을 각 치료요법군 별로 정리하였다(표 1). 모든 이상반응은 각 발현부위 별로 발현빈도가 기재되어 있으며 빈도에 대해서는 다음의 정의가 사용되었다; 매우 흔하게(≥ 1/10), 흔하게(≥ 1/100 ∼ < 1/10), 흔하지 않게(≥ 1/1,000 ∼ < 1/100), 드물게(≥ 1/10,000 ∼ < 1/1,000), 매우 드물게(< 1/10,000), 알 수 없음(사용 가능한 자료로부터 추정 불가).
표 1. 리나글립틴을 1일 5 mg씩 단독 또는 추가 병용 요법으로 투여한 피험자에게 보고된 이상반응 (위약-대조 시험 통합 분석)

AD
2) 저혈당
위약대조 임상시험에서 이 약 5 mg을 투여받은 총 4302명 환자 중 저혈당을 보고한 환자는 471명 (10.9%)이었으며, 반면 위약투여군 총 2364명 환자 중 저혈당을 보고한 환자는 275명 (11.6%) 이었다. 이 약 투여군에서 보고된 저혈당증은 경증(80%; N=384) 또는 중등(16.6%; N=78) 또는 중증(1.9%; N=9)이었다. 리나글립틴, 메트포르민 및 설포닐우레아 3가지 제제를 병용투여 하였을 때 보고된 저혈당증은 이 약 투여군에서 22.9%, 위약 투여군에서 14.8%이었다.
3) 실험실적 검사
이 약 투여군과 위약 투여군 비교시 실험실적 검사수치에서 뚜렷한 차이는 관찰되지 않았다. 1% 이상 빈번하게 일어난 실험실적 검사 결과로는 요산 결과가 위약군에서 1.3%, 시험군에서 2.7% 증가되는 것이 관찰되었다.
4) 시판후 조사
시판후 조사로부터 다음의 이상반응이 보고되었다.
|
계통분류 |
이상반응 |
|
면역계 이상 |
혈관부종 |
|
두드러기 |
|
|
피부 및 피하조직 이상 |
발진 |
5) 국내 자발적 이상사례 보고자료(1989-2014년)를 분석한 결과, 이상사례가 보고된 다른 의약품에서 발생한 이상사례에 비해 통계적으로 유의하게 많이 보고된 이상사례는 다음과 같이 나타났다. 다만, 이로서 곧 해당성분과 다음의 이상사례 간에 인과관계가 입증된 것을 의미하는 것은 아니다.
- 소화기계 : 소화불량
- 전신 및 투여부위 이상: 부종, 얼굴부종, 말초부종
6) 국내 시판 후 이상사례 보고자료(1989-2015년)를 토대로 실마리정보 분석·평가 결과 새로 확인된 이상사례는 다음과 같다. 다만, 이로서 곧 해당성분과 다음의 이상사례 간에 인과관계가 입증된 것을 의미하는 것은 아니다.
- 대사 및 영양계: 체중감소
- 정신계 : 식욕증가
7) 국내 시판 후 조사결과
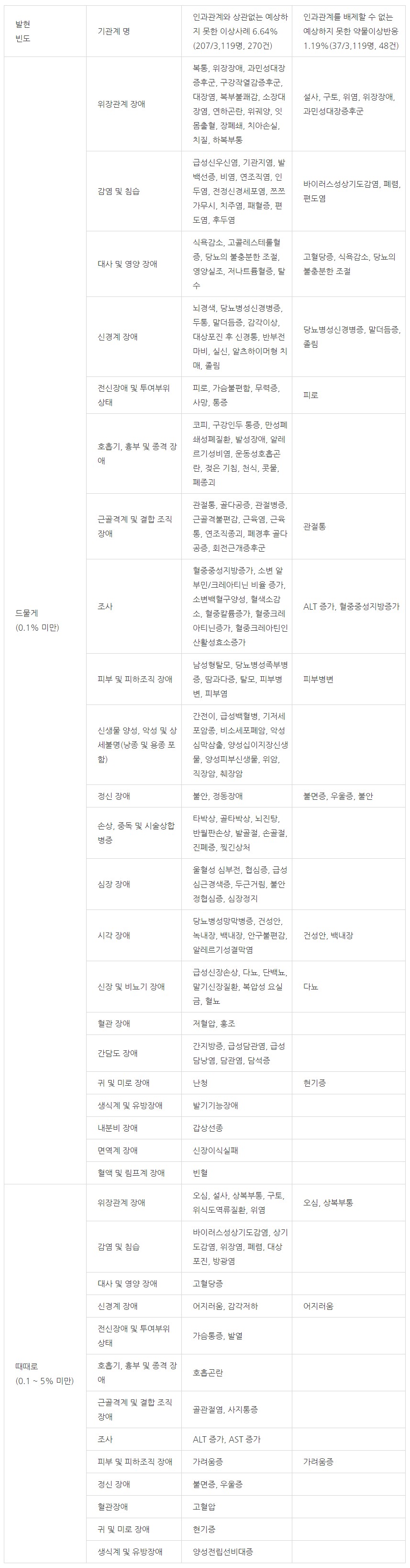
국내에서 재심사를 위하여 6년 동안 3,119명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 7.69%(240/3,119명, 총 313건)로 보고되었다. 이 중 인과관계와 상관 없는 중대한 이상사례 및 인과관계를 배제할 수 없는 중대한 약물이상반응은 발현 빈도에 따라 아래 표에 나열하였다.

AD
또한, 인과관계와 상관없는 예상하지 못한 이상사례와 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응은 발현 빈도에 따라 다음의 표에 나열하였다.
‧₊˚.⋆·ฺ.∗̥✩⁺˚ ੈ‧˚૮꒰˵• ﻌ •˵꒱აੈ✩‧₊˚ੈ*:゚*。.⋆·ฺᐝ.∗̥⁺˚





'약 효능효과, 부작용, 주의사항' 카테고리의 다른 글
| [약] 아보다트연질캡슐0.5mg 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.06.01 |
|---|---|
| [약] 아보다트연질캡슐0.5mg 부작용, 이상반응 (0) | 2019.06.01 |
| [약] 가나칸정50mg 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.06.01 |
| [약] 트라젠타정 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.06.01 |
| [약] 콩코르정2.5mg 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.05.31 |
| [약] 트레스탄캡슐 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.05.31 |
| [약] 도란사민캡슐 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.05.31 |
| [약] 라벤다크림15g 효능 효과, 부작용, 이상반응, 주의사항 (0) | 2019.05.31 |